
AMONDYS 45 se utiliza para tratar a pacientes con distrofia muscular de Duchenne (DMD) que tienen una mutación confirmada en el gen de la distrofina que puede ser tratada mediante la omisión del exón 45.
Esta indicación está aprobada con aprobación urgente según un aumento de la producción de distrofina en el músculo esquelético observado en pacientes tratados con AMONDYS 45. La aprobación continua para esta indicación puede estar supeditada a la verificación del beneficio clínico en ensayos confirmatorios.
Embárquese en el recorrido de Beck con AMONDYS 45 mientras él y su familia comparten sus objetivos y experiencias de tratamiento, cómo AMONDYS 45 se adapta a sus vidas y el papel fundamental que desempeña SareptAssist en su recorrido.
Para recibir AMONDYS 45, los pacientes deben presentar una mutación en el gen de la distrofina que pueda tratarse mediante la omisión del exón 45. Las mutaciones se confirman mediante una prueba genética, que debe ser interpretada por un proveedor de servicios de salud.
Las personas alérgicas al casimersen o a alguno de los componentes de AMONDYS 45 no deben recibir este fármaco. Las reacciones alérgicas graves al casimersen han incluido anafilaxia, que puede incluir dificultad para respirar, opresión en el pecho y angioedema que puede incluir hinchazón de la boca, la cara, los labios o la lengua.
Se han producido reacciones alérgicas graves, incluidas angioedema (hinchazón debajo de la piel, que puede incluir la boca, la cara, los labios o la lengua) y anafilaxia (una reacción alérgica grave y potencialmente mortal) en pacientes tratados con AMONDYS 45. Los pacientes deben buscar atención médica inmediata si presentan signos y síntomas de reacciones alérgicas. Su médico le proporcionará el tratamiento médico adecuado que puede incluir ralentizar, interrumpir o discontinuar la infusión de AMONDYS 45. Su médico lo controlará hasta que la afección se resuelva.
Se observó daño renal en animales que recibieron casimersen. Aunque no se observó daño renal en los estudios clínicos con AMONDYS 45, se ha producido daño renal potencialmente mortal con otros fármacos que funcionan de manera similar. Su médico puede recomendar análisis de orina y sangre antes de iniciar el tratamiento, seguidos de análisis de orina cada mes y un análisis de sangre cada 3 meses para controlar los riñones.
Los efectos secundarios que se produjeron en al menos el 20 % de los pacientes tratados con AMONDYS 45 y con al menos el 5 % más de frecuencia que en los pacientes que recibieron una infusión intravenosa (i.v.) inactiva fueron (AMONDYS 45, placebo): infección de las vías respiratorias superiores (65 %, 55 %), tos (33 %, 26 %), fiebre (33 %, 23 %), dolor de cabeza (32 %, 19 %), dolor articular (21 %, 10 %), y dolor en la boca y la garganta (21 %, 7 %).
Debe hablar con su médico sobre todos los medicamentos que esté tomando. Su médico es la mejor persona para aconsejarlo sobre sus medicamentos.
AMONDYS 45 se suministra en un vial de dosis única de 2 ml que contienen 100 mg de casimersen (50 mg/ml). La solución es un líquido transparente a ligeramente opalescente e incoloro que puede contener cantidades ínfimas de partículas amorfas de color blanco a blanquecino.
La cantidad de AMONDYS 45 que se le administra se basa en su peso. La dosis recomendada de AMONDYS 45 es de 30 miligramos de solución por kilogramo de peso corporal, infundida por vía intravenosa (i.v.), una vez a la semana durante 35 a 60 minutos, a través de un filtro en línea de 0.2 micrones.
AMONDYS 45 se administra una vez a la semana mediante infusión intravenosa (i.v.) a través de un filtro en línea de 0.2 micrones. Una infusión i.v. es una forma de administrar el medicamento directamente en el torrente sanguíneo a través de una vena. Su médico puede analizar el uso de un puerto, que es un dispositivo instalado bajo la piel para su uso repetido en la administración de medicamentos i.v. La infusión de AMONDYS 45 siempre es administrada y supervisada por un proveedor de servicios de salud.
AMONDYS 45 se infundirá por vía intravenosa durante 35 a 60 minutos a través de un filtro en línea de
Puede recibir sus infusiones en el consultorio de su médico, en un centro de infusión o en su hogar. Es posible que usted y su médico tengan que analizar estas opciones, lo que incluye si la terapia en el hogar es una opción para usted.
Si se omite una dosis de AMONDYS 45, esta se puede administrar tan pronto como sea posible después de la dosis programada. Hable con su médico si omite una dosis.
Pida a su médico las instrucciones para el paciente proporcionadas por el fabricante de su puerto. Siga atentamente estas u otras instrucciones proporcionadas por su médico para el cuidado del lugar del puerto a fin de reducir el riesgo de complicaciones, incluidas las infecciones.
* Consulte siempre la guía de instrucciones de uso (IDU) del fabricante del puerto para obtener más información sobre la seguridad y las precauciones, y pida a su proveedor de servicios de salud que revise las instrucciones de uso relevantes del puerto con usted.
Una higiene adecuada es una parte importante de la prevención de infecciones. Es posible que reciba instrucciones sobre cómo mantener el puerto y la piel alrededor de este limpios después de su colocación y de cada uso.
* Consulte siempre la guía de instrucciones de uso (IDU) del fabricante del puerto para obtener más información sobre seguridad y precauciones, y pida a su proveedor de servicios de salud que revise las instrucciones de uso relevantes del puerto con usted.
En las instrucciones que reciba de su médico, se le explicará en qué casos debe comunicarse con él. Póngase siempre en contacto con su médico si ocurre lo siguiente:
* Consulte siempre la guía de instrucciones de uso (IDU) del fabricante del puerto para obtener más información sobre seguridad y precauciones, y pida a su proveedor de servicios de salud que revise las instrucciones de uso relevantes del puerto con usted.
Reacciones de hipersensibilidad: Se han producido reacciones alérgicas graves, incluidos angioedema y anafilaxia, en pacientes tratados con AMONDYS 45. Los pacientes deben buscar atención médica inmediata si presentan signos y síntomas de reacciones alérgicas. Su médico le proporcionará el tratamiento médico adecuado, que puede incluir ralentizar, interrumpir o discontinuar la infusión de AMONDYS 45. Su médico lo controlará hasta que la afección se resuelva.
Monitoreo y toxicidad renal: Se observó daño renal en animales que recibieron casimersen. Aunque no se observó daño renal en los estudios clínicos con AMONDYS 45, se ha producido daño renal potencialmente mortal con otros fármacos que funcionan de manera similar. Su médico puede recomendar análisis de orina y sangre antes de iniciar el tratamiento, seguidos de análisis de orina cada mes y un análisis de sangre cada 3 meses para controlar los riñones.
EFECTOS SECUNDARIOS OBSERVADOS EN AL MENOS EL 20 % DE LOS PACIENTES TRATADOS CON AMONDYS 45 Y CON AL MENOS EL 5 % MÁS DE FRECUENCIA QUE EN EL GRUPO DE PLACEBO
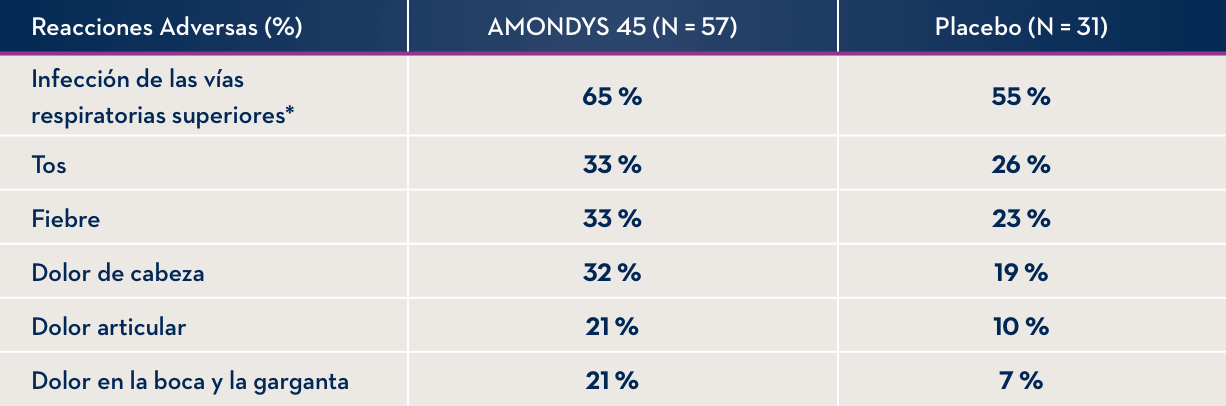
* Incluye infección de las vías respiratorias superiores, infección de nariz o garganta, y congestión o secreción nasal
Otros efectos secundarios que se produjeron en al menos el 10 % de los pacientes tratados con AMONDYS 45 y con al menos el 5 % más de frecuencia que en los pacientes que recibieron una infusión i.v. inactiva fueron los siguientes:
Las reacciones relacionadas con la infusión, que incluyen erupción, dolor de cabeza, tos, dolor abdominal (incluso dolor en la parte superior del abdomen) y vómitos, ocurrieron en el término de 24 horas desde el inicio de una infusión de AMONDYS 45.
Lo animamos a que notifique a la FDA los efectos secundarios negativos de los fármacos con receta. Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. También puede informar efectos secundarios a Sarepta Therapeutics al 1-888-SAREPTA (1-888-727-3782).
Antes de recibir esta infusión, consulte la información de prescripción completa de AMONDYS 45 (casimersen).
Se requiere una prueba genética para confirmar que la mutación del gen DMD de un paciente es susceptible a la omisión del exón 45. Para obtener más información, explore los recursos sobre pruebas genéticas en Duchenne.com.
AMONDYS 45 es una terapia de omisión del exón. El objetivo de la omisión de exón es permitir que el cuerpo produzca una forma más corta de la proteína distrofina.
Mire este video para descubrir cómo las mutaciones en el gen de la distrofina hacen que el cuerpo no pueda producir suficiente proteína distrofina funcional, o ninguna, y cómo la omisión de exón apunta a proporcionar una solución mediante la producción de una forma más corta de la proteína distrofina.
El gen de la distrofina es el gen más grande del cuerpo, compuesto por 79 exones (porciones de un gen) que están unidos para formar las instrucciones para producir distrofina —una proteína que los músculos necesitan para funcionar correctamente.
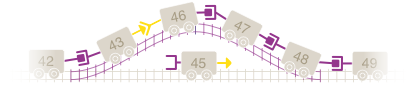
Piense en los exones como los vagones de un tren de juguete, cada uno con una conexión especial que permite conectar un vagón a otro. Para que todos los vagones se muevan juntos como un tren, las conexiones entre vagones deben coincidir para que puedan conectarse entre sí.

Duchenne es causada por una mutación o cambio genético en el gen de la distrofina. En la mayoría de los casos, faltan uno o más exones. Esto provoca errores en las instrucciones para producir distrofina, y el cuerpo no es capaz de producir suficiente o ninguna proteína distrofina que funcione.
Si imaginamos el tren del juguete, faltarían uno o más vagones, lo cual deja a los restantes no conectados. En este ejemplo, podemos ver que falta el vagón 44. Esto hace que los vagones 43 y 45 no puedan conectarse.

La tecnología de omisión del exón permite al cuerpo producir proteína distrofina mediante la omisión de un exón específico. AMONDYS 45 actúa mediante la omisión de exón y el resultado es una forma más corta de la proteína distrofina.
Con nuestro tren, apartaríamos un vagón determinado a un lado para “omitirlo”, y poder encontrar un vagón con la conexión adecuada para permitir la conexión con el resto de los vagones. En nuestro ejemplo, se omitiría el vagón 45 para permitir que el vagón 43 se conecte con el vagón 46. Este nuevo tren sería más corto, pero todos los vagones seguirían conectados.
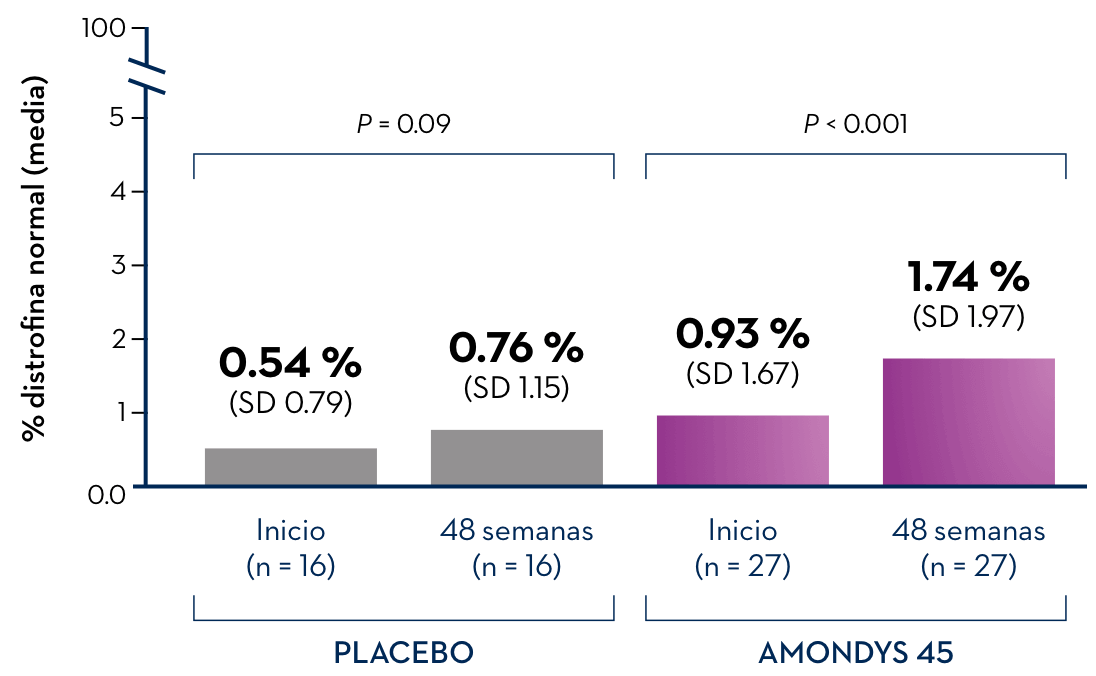
Los niños varones que recibieron AMONDYS 45 tuvieron respuestas variables en la cantidad de aumento de la producción de distrofina después de 48 semanas de tratamiento. Los datos de un estudio clínico en curso mostraron que 27 niños varones (mediana de edad de 9 años) que recibían AMONDYS 45 presentaban un aumento promedio del 1.74 % de la producción normal de distrofina en comparación con el 0.76 % de la producción normal de los niños varones que recibían una infusión de placebo (n = 16).

Acompañe a Beck y su familia mientras enfrentan la vida con distrofia muscular de Duchenne Descubra los diversos intereses de Beck, sus contribuciones a la comunidad con Duchenne y la motivación con respecto a su tratamiento ininterrumpido con AMONDYS 45.
En el estudio 1 que se encuentra en curso, se analiza si se produjo la omisión del exón 45 en el gen de la distrofina de los niños varones tratados con AMONDYS 45.
En el análisis provisional del tejido de biopsia muscular obtenido al inicio y en la semana 48 de los pacientes del estudio 1, los pacientes que recibieron AMONDYS 45 (n = 27) mostraron un aumento significativo en la omisión del exón 45 (p < 0.001) en comparación con el inicio.
Los pacientes que recibieron placebo (n = 16) no mostraron un aumento significativo en la omisión del exón 45 (p = 0.808).
El nivel de omisión de exón se correlacionó positivamente con la expresión de la proteína distrofina.

El eje y representa el 5 % en una escala del 100 %
* Sujetos sanos = personas sin DMD.

SareptAssist es un programa de apoyo diseñado para ayudar a los pacientes que buscan información sobre AMONDYS 45 (casimersen). Nuestro equipo especializado proporcionará información sobre:


Regístrese para recibir noticias e información de Sarepta Therapeutics, incluidas actualizaciones sobre los productos y servicios de Sarepta.
* indica un campo obligatorio
AMONDYS 45 se utiliza para tratar a pacientes con distrofia muscular de Duchenne (DMD) que tienen una mutación confirmada en el gen de la distrofina que puede ser tratada mediante la omisión del exón 45.
Esta indicación está aprobada con aprobación urgente según un aumento de la producción de distrofina en el músculo esquelético observado en pacientes tratados con AMONDYS 45. La aprobación continua para esta indicación puede estar supeditada a la verificación del beneficio clínico en ensayos confirmatorios.
Contraindicaciones: No debe recibir AMONDYS 45 si es alérgico al casimersen o a cualquiera de los componentes de AMONDYS 45. Las reacciones alérgicas graves al casimersen han incluido anafilaxia, que puede incluir dificultad para respirar, opresión en el pecho y angioedema que puede incluir hinchazón de la boca, la cara, los labios o la lengua.
Reacciones de hipersensibilidad: Se han producido reacciones alérgicas graves, incluidos angioedema y anafilaxia, en pacientes tratados con AMONDYS 45. Los pacientes deben buscar atención médica inmediata si presentan signos y síntomas de reacciones alérgicas. Su médico le proporcionará el tratamiento médico adecuado que puede incluir ralentizar, interrumpir o discontinuar la infusión de AMONDYS 45. Su médico lo controlará hasta que la afección se resuelva.
Monitoreo y toxicidad renal: Se observó daño renal en animales que recibieron casimersen. Aunque no se observó daño renal en los estudios clínicos con AMONDYS 45, se ha producido daño renal potencialmente mortal con otros fármacos que funcionan de manera similar. Su médico puede recomendar análisis de orina y sangre antes de iniciar el tratamiento, seguidos de análisis de orina cada mes y un análisis de sangre cada 3 meses para controlar los riñones.
Reacciones adversas: Los efectos secundarios que se produjeron en al menos el 20 % de los pacientes tratados con AMONDYS 45 y con al menos el 5 % más de frecuencia que en los pacientes que recibieron una infusión intravenosa (i.v.) inactiva fueron (AMONDYS 45, placebo): infección de las vías respiratorias superiores (65 %, 55 %), tos (33 %, 26 %), fiebre (33 %, 23 %), dolor de cabeza (32 %, 19 %), dolor articular (21 %, 10 %), y dolor en la boca y la garganta (21 %, 7 %).
Otros efectos secundarios que se produjeron en al menos el 10 % de los pacientes tratados con AMONDYS 45 y con al menos el 5 % más de frecuencia que en los pacientes que recibieron una infusión intravenosa (i.v.) inactiva fueron: dolor de oído, náuseas, infección de oído, dolor después de una lesión, y mareos y vahídos.
¿Qué debo hacer si tengo efectos secundarios?
Pida asesoramiento a su proveedor de servicios de salud sobre cualquier efecto secundario que le preocupe.
Lo animamos a que notifique a la Administración de Alimentos y Medicamentos (Food and Drug Administration, FDA) los efectos secundarios negativos de los fármacos con receta. Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. También puede informar efectos secundarios a Sarepta Therapeutics al 1-888-SAREPTA (1-888-727-3782).
La información proporcionada aquí no incluye todo lo que se conoce sobre AMONDYS 45. Para obtener más información, hable con su proveedor de servicios de salud.
Antes de recibir esta infusión, consulte la información de prescripción completa de AMONDYS 45 (casimersen).
Contraindicaciones: No debe recibir AMONDYS 45 si es alérgico al casimersen o a cualquiera de los componentes de AMONDYS 45. Las reacciones alérgicas graves al casimersen han incluido anafilaxia, que puede incluir dificultad para respirar, opresión en el pecho y angioedema que puede incluir hinchazón de la boca, la cara, los labios o la lengua.
Reacciones de hipersensibilidad: se han producido reacciones alérgicas graves, incluidos angioedema y anafilaxia, en pacientes tratados con AMONDYS 45. Los pacientes deben buscar atención médica inmediata si presentan signos y síntomas de reacciones alérgicas. Su médico le proporcionará el tratamiento médico adecuado que puede incluir ralentizar, interrumpir o discontinuar la infusión de AMONDYS 45. Su médico lo controlará hasta que la afección se resuelva.
Monitoreo y toxicidad renal: Se observó daño renal en animales que recibieron casimersen. Aunque no se observó daño renal en los estudios clínicos con AMONDYS 45, se ha producido daño renal potencialmente mortal con otros fármacos que funcionan de manera similar. Su médico puede recomendar análisis de orina y sangre antes de iniciar el tratamiento, seguidos de análisis de orina cada mes y un análisis de sangre cada 3 meses para controlar los riñones.
Reacciones adversas: Los efectos secundarios que se produjeron en al menos el 20 % de los pacientes tratados con AMONDYS 45 y con al menos el 5 % más de frecuencia que en los pacientes que recibieron una infusión intravenosa (i.v.) inactiva fueron (AMONDYS 45, placebo): infección de las vías respiratorias superiores (65 %, 55 %), tos (33 %, 26 %), fiebre (33 %, 23 %), dolor de cabeza (32 %, 19 %), dolor articular (21 %, 10 %), y dolor en la boca y la garganta (21 %, 7 %).
AMONDYS 45 se utiliza para tratar a pacientes con distrofia muscular de Duchenne (DMD) que tienen una mutación confirmada en el gen de la distrofina que puede ser tratada mediante la omisión del exón 45.
Esta indicación está aprobada con aprobación acelerada según un aumento de la producción de distrofina en el músculo esquelético observado en pacientes tratados con AMONDYS 45. La aprobación continua para esta indicación puede estar supeditada a la verificación del beneficio clínico en ensayos confirmatorios.
Contraindicaciones: No debe recibir AMONDYS 45 si es alérgico al casimersen o a cualquiera de los componentes de AMONDYS 45. Las reacciones alérgicas graves al casimersen han incluido anafilaxia, que puede incluir dificultad para respirar, opresión en el pecho y angioedema que puede incluir hinchazón de la boca, la cara, los labios o la lengua.
Reacciones de hipersensibilidad: se han producido reacciones alérgicas graves, incluidos angioedema y anafilaxia, en pacientes tratados con AMONDYS 45. Los pacientes deben buscar atención médica inmediata si presentan signos y síntomas de reacciones alérgicas. Su médico le proporcionará el tratamiento médico adecuado que puede incluir ralentizar, interrumpir o discontinuar la infusión de AMONDYS 45. Su médico lo controlará hasta que la afección se resuelva.
Monitoreo y toxicidad renal: Se observó daño renal en animales que recibieron casimersen. Aunque no se observó daño renal en los estudios clínicos con AMONDYS 45, se ha producido daño renal potencialmente mortal con otros fármacos que funcionan de manera similar. Su médico puede recomendar análisis de orina y sangre antes de iniciar el tratamiento, seguidos de análisis de orina cada mes y un análisis de sangre cada 3 meses para controlar los riñones.
Reacciones adversas: Los efectos secundarios que se produjeron en al menos el 20 % de los pacientes tratados con AMONDYS 45 y con al menos el 5 % más de frecuencia que en los pacientes que recibieron una infusión intravenosa (i.v.) inactiva fueron (AMONDYS 45, placebo): infección de las vías respiratorias superiores (65 %, 55 %), tos (33 %, 26 %), fiebre (33 %, 23 %), dolor de cabeza (32 %, 19 %), dolor articular (21 %, 10 %), y dolor en la boca y la garganta (21 %, 7 %).
Otros efectos secundarios que se produjeron en al menos el 10 % de los pacientes tratados con AMONDYS 45 y con al menos el 5 % más de frecuencia que en los pacientes que recibieron una infusión intravenosa (i.v.) inactiva fueron: dolor de oído, náuseas, infección de oído, dolor después de una lesión, y mareos y vahídos.
¿Qué debo hacer si tengo efectos secundarios?
Pida asesoramiento a su proveedor de servicios de salud sobre cualquier efecto secundario que le preocupe.
Lo animamos a que notifique a la Administración de Alimentos y Medicamentos (Food and Drug Administration, FDA) los efectos secundarios negativos de los fármacos con receta. Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088. También puede informar efectos secundarios a Sarepta Therapeutics al 1-888-SAREPTA (1-888-727-3782).
La información proporcionada aquí no incluye todo lo que se conoce sobre AMONDYS 45. Para obtener más información, hable con su proveedor de servicios de salud.
Antes de recibir esta infusión, consulte la información de prescripción completa de AMONDYS 45 (casimersen).